樊英教授:芦康沙妥珠单抗正式获批,TNBC 治疗领域的又一里程碑,将显著改善 mTNBC 患者的治疗结局
2024 年 11 月 27 日,国家药品监督管理局(NMPA)官网显示,已正式完全批准四川科伦博泰生物医药股份有限公司开发的注射用芦康沙妥珠单抗(SKB264/sac-TMT,商品名:佳泰莱®)用于既往至少接受过 2 种系统治疗(其中至少 1 种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者(CXSS2300093)。芦康沙妥珠单抗是一款靶向 TROP2 的抗体偶联药物(ADC),成为中国首个获批上市的国产创新 TROP2 ADC。芦康沙妥珠单抗获批上市,将为我国晚期三阴性乳腺癌患者带来全新的治疗选择与希望!
在此重要时刻,「丁香园」特邀中国医学科学院肿瘤医院樊英教授,寄语祝贺芦康沙妥珠获批晚期 TNBC 二线及以上适应症。

OptiTROP-Breast01 研究第一作者樊英教授表示:
热烈祝贺首个中国原创的 TROP2 ADC 药物佳泰莱®(SKB264/ 芦康沙妥珠单抗)成功上市,这是我国原创新药在 TNBC 治疗领域的又一里程碑。作为其 III 期临床试验 OptiTROP-Breast01 的主要研究者,亲眼见证了,研究从立项到申报上市,处处展现出中国智慧和中国速度。OptiTROP-Breast01 研究大获全胜,研究结果表明相较于化疗,芦康沙妥珠单抗具有显著的生存优势和可管可控的安全性,让晚期 TNBC 患者在治疗之路上看到了更多的可能与希望。我们相信,随着芦康沙妥珠单抗在临床上的广泛应用,将显著改善晚期 TNBC 患者的生存质量,延长患者生命。
芦康沙妥珠单抗作为中国创新药出海的代表,已在全球范围内注册开展了多项 III 期临床试验,不久的将来我们有望看到中国创新药物在世界舞台上更多高光时刻。让我们携手共进,以芦康沙妥珠单抗为契机,不断创新,不断突破,共同书写中国乃至全球乳腺癌治疗领域的新篇章。
芦康沙妥珠单抗
(SKB264/sac-TMT)
聚力创新,成就非凡
ADC 由于能够对癌细胞进行精准打击,被称为“魔法子弹”,这种创新疗法的出现为包括乳腺癌在内的许多癌症患者带来了新的治疗选择。芦康沙妥单抗正是一款 TROP2 ADC 明星产品,由科伦博泰自主研发。2022 年 5 月,科伦博泰授予默沙东在大中华区以外的所有地区开发、制造及商业化芦康沙妥珠单抗(SKB264 /sac-TMT)的独家权利。
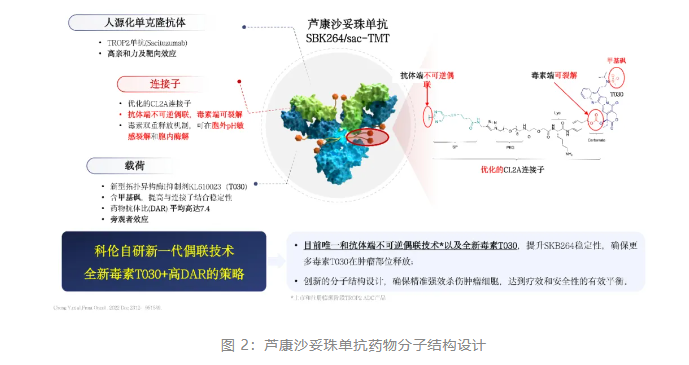
科伦博泰坚持从源头上创新,芦康沙妥珠单抗从设计之初就力求完美,采取当下最主流最成功的设计理念和策略,中等毒性的载药、高药物抗体比(DAR)、可裂解的连接子及可发挥旁观者效应。靶向 TROP2 的人源化单克隆抗体(Sacituzumab)通过创新的且经过优化的可裂解的连接子 CL2A 与自研的新型拓扑异构酶I抑制剂 KL610023(T030)连接组成,药物抗体比平均高达 7.4:1。该药的作用机理为:芦康沙妥珠单抗与肿瘤细胞表面的 TROP2 抗原特异性结合后被肿瘤细胞内吞,在溶酶体作用下释放 T030,杀伤肿瘤细胞;T030 穿透肿瘤细胞膜,发挥旁观者效应,进一步杀伤周围肿瘤细胞;在肿瘤高代谢所致的酸性环境中,芦康沙妥珠单抗连接子毒素端发生裂解,释放 T030,杀伤肿瘤细胞。综上所述,芦康沙妥珠单抗通过三重机制精准强效的杀伤肿瘤细胞,兼顾疗效和安全性,达到全面平衡,实现“魔法子弹”的功效,药物分子结构和机制的优势最终转化成临床研究中更好的数据和患者生存获益。
OptiTROP-Breast01 研究
卓尔不群,创造历史
芦康沙妥珠单抗本次获批是基于 III 期临床研究 OptiTROP-Breast01 的阳性结果。这是一项多中心、随机对照、开放标签的 III 期临床研究(NCT05347134),由中国医学科学院肿瘤医院徐兵河院士和江苏省人民医院殷咏梅教授共同牵头,立足于 mTNBC 治疗手段匮乏的临床难点,旨在评估芦康沙妥珠单抗相较于医生选择的化疗(艾立布林、长春瑞滨、吉西他滨和卡培他滨)治疗局部复发或转移性 TNBC 患者的有效性和安全性。
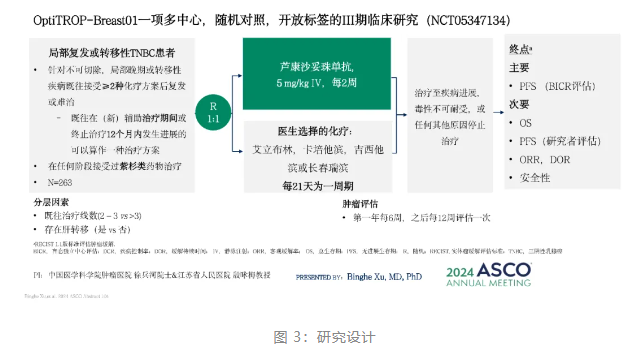
研究结果显示,与化疗相比,芦康沙妥珠单抗在 PFS 和 OS 上均显示出具有显著统计学意义和临床意义的改善。芦康沙妥珠单抗组的 mPFS 为 6.7 个月(HR:0.32;95% CI:0.22-0.44;p<0.00001),与化疗相比,疾病进展或死亡风险显著降低 68%;mOS 尚未达到,但已跨越疗效界值(0.0042),死亡风险显著降低 47%(HR:0.53;95% CI: 0.36,-0.78;P=0.0005);ORR 为 45.4%,mDOR 为 7.1 月。整体安全性临床易于管控,最常见的是血液学不良反应,TRAE 导致的停药比例低(仅1.5%)。

芦康沙妥珠单抗研究展望
勇立潮头,全面奋进
对于 HR+/HER2-mBC 芦康沙妥珠单抗同样表现抢眼,2023 年 ESMO 大会,公布了其用于经过多线治疗的 HR+/HER2-mBC 的初步结果(数据来自 KL264-01 篮子研究),疗效令人欣喜,ORR 高达 36.8%,mPFS 长达 11.1 个月;同时,整体安全性可管可控,最常见的是血液学不良反应。不仅如此,2024 年 8 月 19 日,芦康沙妥珠单抗用于治疗经 EGFR-TKI 和含铂化疗治疗失败的 EGFR 突变局部晚期或转移性非小细胞肺癌(NSCLC)的新药申请(NDA)获 NMPA 药品审评中心(CDE)受理,并纳入优先审评。同年 10 月 31 日,芦康沙妥珠单抗用于治疗 EGFR-TK I治疗进展的 EGFR 突变局部晚期或转移性 NSCLC 的新药申请获 CDE 受理并纳入优先审评。未来随着两项适应症的获批,芦康沙妥珠单抗有望改变 EGFR-TKI 耐药后晚期 NSCLC 患者的治疗格局。同时,芦康沙妥珠单抗在妇科肿瘤和消化道肿瘤也相继取得了出色的成果。芦康沙妥珠单抗展现出了同类最佳的潜质,立足于临床巨大的未被满足的治疗需求,科伦博泰携手默沙东已注册开展了 17 项 III 期临床试验(20241028 from ClinicalTrials.gov & Chinadrugtrials 公开信息),探索芦康沙妥珠单抗在不同肿瘤、不同疾病阶段、不同治疗策略的疗效和安全性。随着临床试验项目不断地加码和加速,芦康沙妥珠单抗有望从「冲锋舟」化身「航空母舰」。芦康沙妥珠单抗作为中国创新药出海的代表,也将成为 TROP2 ADC 类药物的重要代表。

总而言之,芦康沙妥珠单抗的获批上市将改变晚期 TNBC 治疗格局,同时改善 TROP2 ADC 药物的临床可及性,为中国晚期 TNBC 患者带来更有效更安全的治疗选择。展望未来,芦康沙妥珠单抗有望惠及全球广大肿瘤患者,帮助患者延长生命和改善生活质量,奠定中国创新药在全球肿瘤研发和治疗领域的地位。

