CLDN18.2 ADC再添强将!SKB315惊艳亮相ESMO
胃癌是全球发病率第五、死亡率第四的恶性肿瘤。中国更是胃癌高发国家,发病与死亡人数分别占全球的42.6%和45.0%[1],且多数患者确诊时已属晚期。当前,晚期胃癌治疗模式已从化疗演进至免疫和靶向治疗,而HER2靶向治疗仅能覆盖10%-20%的患者,绝大多数HER2阴性患者仍以化疗±免疫为主要治疗手段,整体预后不佳[2],中位生存期普遍仅1年左右,亟需创新疗法的介入。
CLDN18.2:继HER2之后的“第二战场”
随着胃癌治疗迈入精准医学时代,CLDN18.2成为继HER2之后的又一热门靶点。作为一种紧密连接蛋白,CLDN18.2在正常组织中仅低表达于在胃粘膜上已分化的上皮细胞,而在胃癌进展过程中,细胞极性的改变会导致其暴露于细胞表面,从而提高抗体治疗的可及性。更关键的是,CLDN18.2不仅在胃癌中高表达,还在胰腺癌(50%-70%)、胆管癌(60%-80%)等多种肿瘤组织中过度表达,体现出该靶点在胃癌及“跨瘤种”治疗的核心价值与潜力[3]。
据NextPharma数据库统计,全球在研的CLDN18.2相关项目多达86个,国产管线比例超80%。当前,该靶点唯一上市产品为安斯泰来的佐妥昔单抗,主要用于联合化疗一线治疗CLDN18.2阳性HER2 阴性胃/胃食管结合部癌(GC/GEJC),而ADC药物凭借“精准递送+强效杀伤”的机制优势,正迅速迭代传统化疗和免疫单药疗法,成为CLDN18.2靶点开发的主流方向。
SKB315首次亮相ESMO,疗效与安全性双优
在今年10月的ESMO大会上,科伦博泰首次公布CLDN18.2 ADC药物SKB315的1期临床数据——该研究针对经标准治疗失败的晚期实体瘤(包括GC/GEJC)患者,初步结果惊艳。
ESMO官网的摘要显示,截至2025年2月10日,研究共入组73例患者,其中17例接受剂量为0.3-3.6 mg/kg每三周一次方案,56例接受剂量为3.6-6.0 mg/kg每两周一次方案。在安全性方面,≥3级TRAEs发生率为39.7%,主要为血液学不良反应,未发现治疗相关性死亡,整体安全性可控。
疗效方面,在32例可评估的CLDN18.2阳性(H评分≥80)GC/GEJC患者中(59.4%接受过≥2线治疗,71.9%接受过免疫治疗,中位随访时间9.3个月),SKB315 展现出令人鼓舞的抗肿瘤活性:
-
≥2.4 mg/kg剂量组的ORR为37.5%,DCR为84.4%,mPFS为8.2个月,mOS为12.4个月,mDoR为7.9个月。
-
5.4 mg/kg剂量组的ORR提升至41.7%,DCR高达91.7%。
这一结果表明,即便是在多线治疗失败的晚期GC/GEJC患者中,SKB315仍能显示出明确的疗效,而其优异的“疗效-安全性”平衡将进一步支持后续研究的开展。
CLDN18.2 ADC竞速开启,SKB315综合实力不俗
当前,国内CLDN18.2 ADC研发已进入“竞速阶段”,多款药物进入3期临床,形成了多足鼎立的格局。
根据信达生物今年7月最新披露的1期研究结果,IBI343在治疗CLDN18.2阳性(≥75%肿瘤细胞,IHC≥2+)晚期GC/GEJC患者的6mg/kg剂量组中,ORR为32.3%,DCR为90.3%,mPFS为5.5个月,OS尚未成熟,目前为10.8个月;在8mg/kg剂量组中,ORR为47.1%, DCR为88.2%,mPFS为6.8个月,mOS未达到[4]。安全性方面,≥3级TRAEs发生率为52.6%[5]。
而恒瑞披露的1期研究结果显示,SHR-A1904治疗晚期GC/GEJC患者(部分患者既往已接受过靶向CLDN18.2的治疗)6.0 mg/kg及8.0 mg/kg剂量组ORR分别为24.2%和25.0%;mPFS分别达5.6个月和5.8个月。在CLDN18.2中高表达的患者中,6.0 mg/kg及8.0 mg/kg剂量组ORR分别为26.7%、26.5%,DoR分别为未达到和8.1个月。安全性方面,62.1%的患者发生≥3级TRAEs,无治疗相关性死亡[6]。
礼新医药在去年ASCO会议上汇报了LM-302的1/2期临床数据,其在36例2L及以上CLDN18.2阳性(≥50%肿瘤细胞,IHC≥2+)晚期GC/GEJC患者中,ORR为30.6%,DCR为75.0%,mPFS为7.16个月,mOS未达到,安全性可控[7]。
CMG901/AZD0901是乐普生物、康诺亚和阿斯利康共同开发的CLDN18.2 ADC,根据1期临床研究结果,在最终确定的推荐剂量2.2 mg/kg下,其治疗89例CLDN18.2阳性(≥20%肿瘤细胞,IHC≥2+)晚期GC/GEJC患者的ORR为48%,DCR为71%,mPFS为4.8个月,mOS为11.8个月。CMG901/AZD0901总体耐受性良好,具有可管理的安全性[8]。
此外,此次ESMO大会上,另一款备受关注的在研CLDN18.2 ADC药物ATG-022也发布了最新数据,其治疗晚期GC/GEJC的1/2期研究结果显示:在剂量扩展阶段的30例可评估疗效患者中(IHC染色2+ >20%,接受ATG-022 2.4 mg/kg剂量治疗),观察到1例完全缓解、11例部分缓解和15例疾病稳定,ORR为40%,mPFS为5.1个月。安全性方面,所有患者≥3级TRAE发生率为46.0%,整体安全性可控。
从数据中不难看出,多款临床进展靠前的CLDN18.2 ADC药物已在胃癌领域取得了不错的疗效成绩,而此次首发数据的SKB315,在ORR、DCR、OS、PFS的关键疗效指标上均处于同类药物上游,整体疗效优异。值得注意的是,SKB315的安全性佳,可实现疗效与安全性的平衡,从而能在众多同靶点药物中脱颖而出。
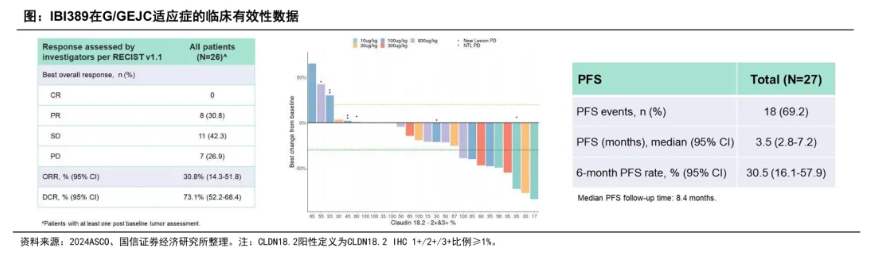
在ADC药物之外,业内对CLDN18.2靶点的探索也延伸至双抗领域,比如信达生物的一款CLDN18.2/CD3双抗IBI389,其治疗标准治疗失败的CLDN18.2阳性晚期GC/GEJC患者的1期临床数据显示:≥10μg/kg剂量组患者的ORR为30.8%,DCR为73.1%,mPFS为3.5个月。安全性上,≥3级TRAE发生率58.3%。
而另一款安斯泰莱开发的CLDN18.2/CD3双抗ASP2138,其治疗晚期GC/GEJC患者的1/1b期数据也在此次ESMO官网上作了更新,结果显示:在36例GC/GEJC患者中(IHC染色≥1+,接受ASP2138 ≥420 μg剂量治疗),观察到10例疾病稳定和5例部分缓解,未经确认的DCR为41.7%。ASP2138在不同CLDN18.2表达水平的肿瘤中均观察到了抗肿瘤活性,且安全性可控。

从初步的疗效数据来看,针对CLND.18靶点,ADC药物的整体疗效相对双抗更优,而在安全性上,两类产品没有明显差距。鉴于两类产品对后线胃癌患者均有不错的治疗效果,其后续临床数据值得期待。
减毒增效,差异化的分子设计
SKB315之所以能在安全性与疗效上表现突出,离不开其独特的差异化分子设计。
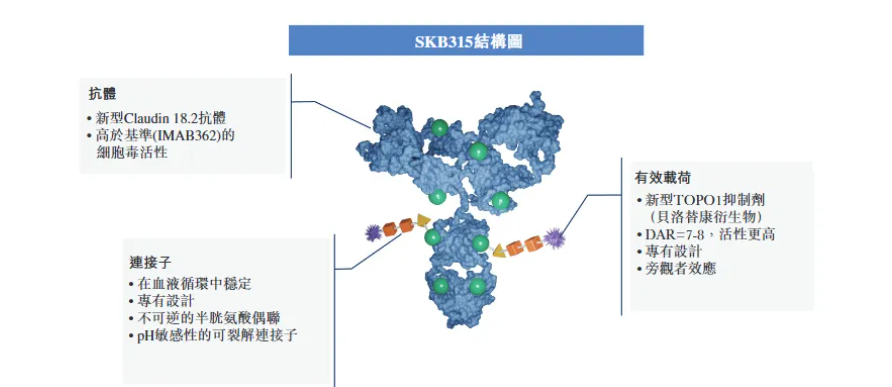
具体来看,SKB315选用新型、中度细胞毒性TOPO1抑制剂以高DAR值与内部开发的人源化靶向CLDN18.2抗体偶联。其采用不可逆的半胱氨酸偶联,能在血液循环中保持稳定,同时具有pH敏感性的可裂解连接子,能保证药物在特定环境下释放有效载荷,发挥靶向细胞杀伤、旁杀及免疫介导的杀伤作用,并且对正常CLDN18.2表达的胃部组织毒性较小。
临床前研究也充分验证了SKB315的优势。安全性方面,SKB315在小鼠及食蟹猴模型试验中,表现出良好的安全性特征,有广泛的治疗窗口,器官毒性有限且可逆;在疗效方面,头对头的体外研究表明,SKB315在多个癌症细胞系中展现出与Zolbetuximab相当的特异性、CLDN18.2亲和力和更高的增殖抑制作用——这意味着,SKB315在治疗从低至高CLDN18.2表达的各种肿瘤方面均有潜力。
总结
在CLDN18.2靶点的全球竞争中,SKB315的首次亮相为国产ADC再添一员强将——其在晚期 GC/GEJC 患者中展现的优异疗效与可控安全性,不仅媲美当前进展最快的同类产品,更在疾病控制(PFS、DCR)上形成了差异化优势。
随着CLDN18.2 ADC研发进入深水区,“联合治疗”与“跨癌种拓展” 已成为行业趋势:目前,SKB315已启动联合免疫疗法的GC/GEJC一线治疗探索,通过 “ADC +免疫” 机制协同突破胃癌的治疗瓶颈;同时,依托 CLDN18.2 在胰腺癌、食管癌等癌种的高表达特征,SKB315也可拓展至更多难治性实体瘤领域。
可以预见,作为科伦博泰一体化OptiDCTM平台的又一创新产品,SKB315将成为推动 CLDN18.2 ADC “从概念验证走向临床获益” 的关键力量,不仅是为晚期胃癌患者带来更长的生存期与更优的生活质量,还有望与TROP2 ADC芦康沙妥珠单抗一起,引领国产ADC在全球肿瘤治疗领域逐步掌握话语权。
[1]Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer,2015, 136(5): E359-E386
[2]CSCO胃癌诊疗指南2024
[3]Claudin18.2 靶点:抗肿瘤治疗的潜力靶点
[4]信达生物官方新闻稿https://mp.weixin.qq.com/s/cwZehU8HtlaRixxVL89PEg?click_id=220
[5]Liu, J., Yang, J., Sun, Y. et al. CLDN18.2–targeting antibody–drug conjugate IBI343 in advanced gastric or gastroesophageal junction adenocarcinoma: a phase 1 trial. Nat Med (2025). https://doi.org/10.1038/s41591-0
25-03783-8
[6]恒瑞On Call官方新闻稿https://mp.weixin.qq.com/s/FfiwKNdOm1OvAnS5JldGmA?scene=1&click_id=3
[7]https://www.asco.org/abstracts-presentations/ABSTRACT451248
[8]https://pubmed.ncbi.nlm.nih.gov/39788133/
